一、(一) 在質譜法中電子撞擊游離法(electron impact ionization, EI)及化學游離法(chemical ionization, CI)常用於揮發性之化合物,何者適用於測定化合物的分子量?何者適用於測定化合物的結構?為什麼?(二) 對於低揮發性、遇熱易分解的大分子,如蛋白質,該選用何種游離法,並說明游離的原理。
解:
(一)
<電子撞擊游離法(electron impact ionization, EI)>
適用於具揮發性且熱穩定性高的待測物,游離方式如下圖,利用經加熱的燈絲( Filament)釋放出電子,在外加電場的作用下使之成為帶有高能量的電子(70eV),並令其撞擊氣態待測物,使待測物游離,游離過程中生成分子離子(Molecular ion)或碎片離子(Fragment ions),在電場的作用下分子離子或碎片離子經聚焦片(Extraction plates)與出口狹縫(Exit slit)聚焦導入質量分析器內,得到質譜圖。
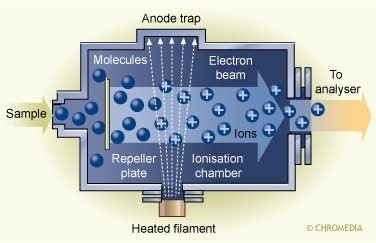
正常情況下,EI生成正離子的數目為負離子的1000倍,故一般探討正離子為主。值得注意的是,用於使待測物游離的電子所具有之能量,應至少等於待測物的游離電位才能使待測物游離,惟此時的游離效率低,為了獲得再現性高的質譜圖,用於撞擊的電子能量設定為70eV,缺點是較高的電子能量將造成分子離子的裂解生成碎片離子,過度裂解時將使待測物的分子量不易判定;使用較低的游離電壓可以控制碎片離子的生成量,但離子的豐度低使得檢測靈敏度降低。
本方法優點靈敏度高,且電子束撞擊能量夠大,可使分子產生足夠地分裂,得到大量各種不同質量之正離子,利於樣品分子斷裂模式之鑑定,故可得結構資訊。
<化學游離法(chemical ionization, CI)>
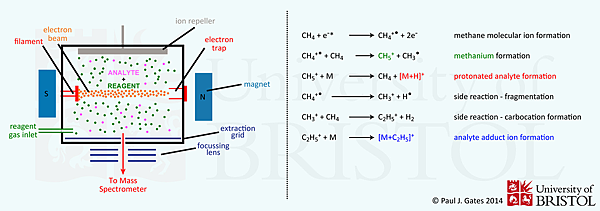
是一種通過離子-分子反應使樣品離子化之方法,此離子化過程中主要利用試劑氣體(Reagent gas)和氣態待測物在離子源混合,因試劑氣體的分壓遠高於氣態待測物(約10000倍),故燈絲釋出的電子主要撞擊到試劑氣體,使試劑氣體先行游離,試劑氣體離再與氣態待測物碰撞使待測物游離,此種游離方式轉移至待測物分子的能量較少,故生成的分子離子不易發生裂解,因此可提供待測物的分子量,常見的試劑氣體有甲烷、氨、異丁烷及二甲基醚 (dimethyl ether, DME)。
以甲烷CH4為例:
(1) CH4經EI生成:CH4+、CH3+、CH2+、CH+等離子
CH4 + e- → CH4+、CH3+、CH2+、CH+、C+
(2) 上述離子與CH4形成具反應性的氣態CH5+、C2H5+、C3H5+等離子。
(3) 具反應性的離子再與待測物分子碰撞結合或發生質子轉移,而生成[M+1]+、[M+29]+與[M+41]+等離子。
一般而言,視試劑氣體與待測物分子二者之質子親和力 (Proton affinity, PA)及熱力學定律,進行下列四種可能的反應:
(1)質子轉移反應 M + XH+ → [M+H]+ + X
(2)叢式結合反應 M + XH+ → [M+XH]+
(3)電荷交換反應 M + XH+ → M+‧ + XH+‧
(4)氫陰離子抽離反應 M + XH+ → [M-H]+ + XH2
CI藉由將能量透過試劑離子間接提供給樣品分子,樣品所獲得能量較低,分子斷裂的碎片較少,可克服因樣品分子之碎片離子過多而偵測不到離子分子之困難,利於求得化合物之分子量。
(三)對於低揮發性、遇熱易分解的大分子,如蛋白質,可以考慮使用電噴灑游離法(electrospray ionization, ESI)或基質輔助雷射脫附游離法(matrix-assisted laser desorption/ionization mass spectrometry, MALDI)。
<ESI>

美國Fenn 教授在1984 年首度發表以電噴灑的方法將蛋白質分析物轉成離子,其示意圖如上圖,當分析物溶液經由施加高電壓的毛細管流出時,高壓電產生的電場會造成溶液中的正負離子分離;以施加正電場的的毛細管為例,正電荷離子會因為排斥的原理往毛細管出口移動,負離子則遠離液體表面,最後在毛細管尖端累積大量的正電荷離子,而形成類似圓錐的帶電液滴,我們稱之為泰勒錐(Taylor cone),此時若加於毛細管的電壓夠大,這些極微小的帶電液滴便會從泰勒錐前端噴灑出來,在帶電液滴受電場進入質譜儀之前,溶劑會在飛行的過程中快速揮發,使得體積快速變小,但是原本液滴中的正電荷數目並不會改變,因此帶電液滴表面的電荷密度會升高,當在液滴表面的電荷間形成的庫倫斥力大於表面張力時,帶電液滴會分裂成更小的液滴,在不斷重複這個過程之後,分析物便會形成帶多價電荷的離子,再進入質量分析器測量其m/z值。
<MALDI >
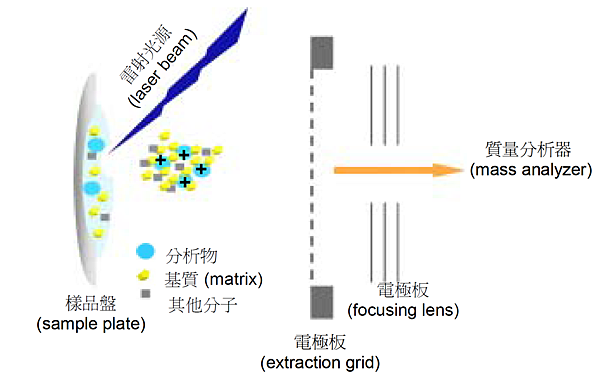
MALDI則由德國的Hillenkamp 教授及日本的Tanaka 先生分別於1988 年提出,此種離子源主要是由雷射光源和金屬樣品盤所構成,將分析樣品和基質(matrix)混合後,將樣品與基質的混和液均勻點至金屬盤之樣品槽中,使其混合物在空氣中自然風乾,待溶劑揮發後,混合液會在金屬盤中形成樣品─基質的共結晶,再以雷射光束照射此固態樣品時,結晶中的基質會吸收雷射光的能量,產生質子並由樣品盤中脫附而出,此過程會同時將分析樣品脫附氣化,產生氣相離子,以進入質量分析器測量其m/z 比值,進而推算其質量。由於基質所扮演的角色有吸收雷射能量及將樣品離子化的功能,因此,選擇基質時除了要配合雷射光源的波長外,還需要考慮樣品的特性。
此方法可以分析分子量數千至數十萬dalton之極性分子,因此在生化分析上相當重要,所得的質譜圖幾乎均為分子離子,碎片相當少,會有二聚體或三聚體的特徵峰出現,且伴隨有+2或+3的多電荷離子特徵峰。
二、 以原子吸收光譜法(atomic absorption spectrometry)分析複雜樣品時,往往需要做背景校正(background correction),常用的背景校正方法有氘燈(deuterium lamp)及Zeeman effect,請說明這二種校正方法的原理。
解:
(一)連續光源校正法(Continuum Source Background Correction)
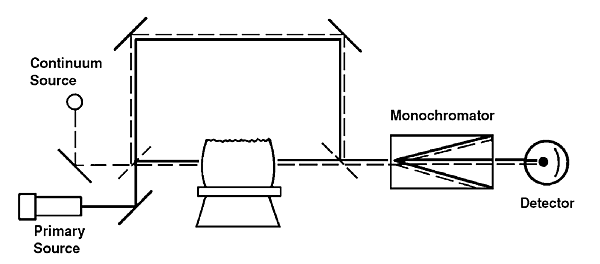
使用氘燈或氫燈做為提供整個紫外光區的連續光源,調整chopper的組態使來自連續光源與來自中空陰極燈的輻射輪流通過原子化器,將狹縫寬度調整至原子化後之樣品對連續光源的吸收可以忽略不計,因此連續光源的強度減弱係反映出樣品基質的影響,將分析物的吸收減去背景對連續光源的吸收,而達背景校正目的。
(二)Zeeman效應校正法(Zeeman Background Correction )
When a magnet is set in an atomization section to apply a magnetic field to the atomic vapor, the absorption spectrum of the atomic vapor will be split, showing the polarization property. On the other hand, the background (BKG) is not affected by the magnetic field, showing neither a split nor the polarization property. It is the Zeeman correction method which uses this phenomenon.
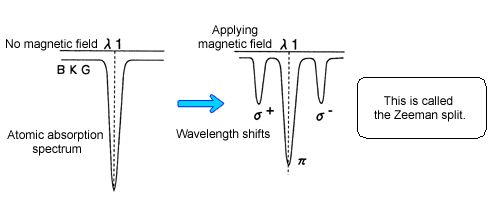

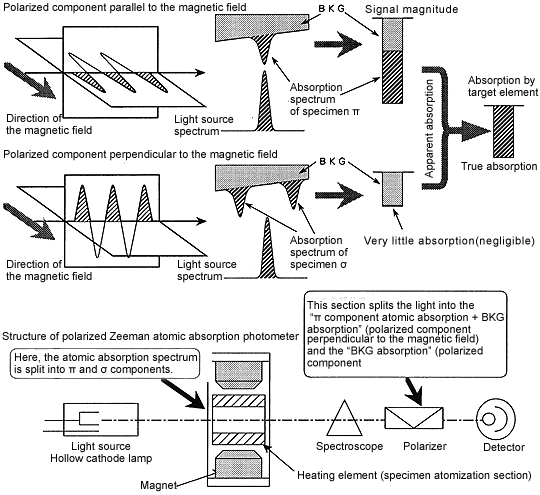
For the component of the light source polarized parallel to the magnetic field, “p component atomic absorption + BKG absorption” is observed. However, only “BKG absorption” is observed for the component polarized vertically to the magnetic field. (Since the s component, which causes atomic absorption is shifted from the measurement wavelength, it does not cause atomic absorption.)
三、紫外光/可見光吸收光譜儀(UV/VIS absorption spectrometer)常用於阿斯匹靈的分析。(一) 請比較雙光束(double beam)和單光束(single beam)儀器設計的優點和缺點。(二) 請說明於定性分析(Qualitative analysis)和定量(Quantitative analysis)分析時,該如何選擇單色器(monochromator)的狹縫寬度(slit width)?
解:
(一)
單光徑儀器具有高能量輸出、良好的訊雜比與樣品置放空間設計較簡潔等優點,惟受光源或偵檢器隨時間的漂移現象或閃爍雜訊影響較嚴重。
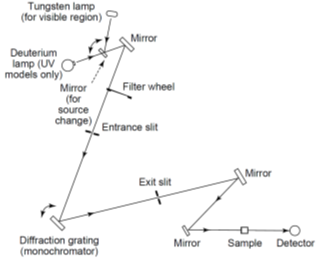
雙光徑儀器補償光源隨時間減弱與偵檢器隨時間的漂移現象,有兩種設計方式:
- 空間上雙光束分光光度計(Double beam-in-space spectrophotometer),設計上為同時得到樣品與參考物的訊號,需要有兩個偵檢器。
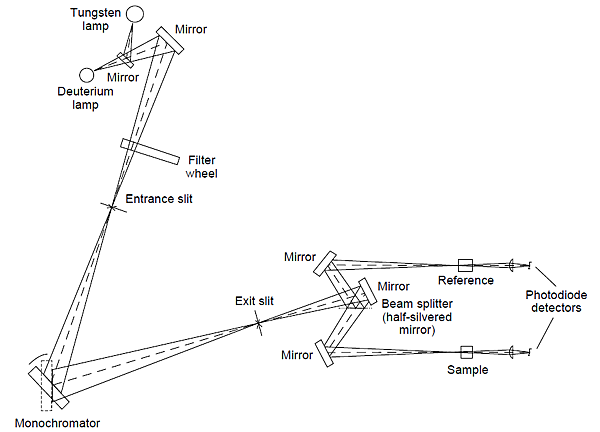
- 時間上雙光束分光光度計(Double beam-in-time spectrophotometer)較佳,因應其可補償所用波長的光強度變異及光電倍增管的暗電流。
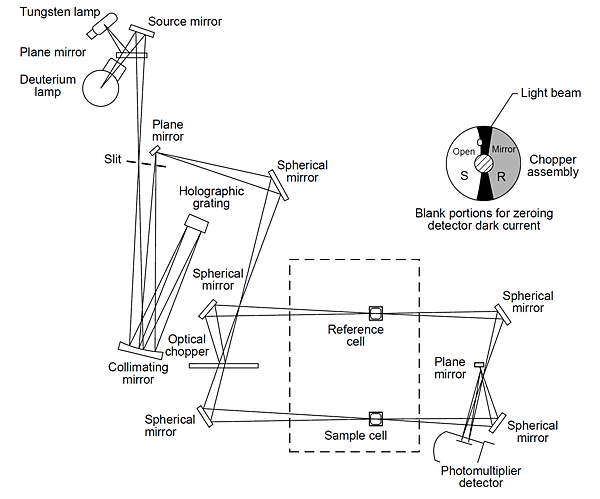
(二)狹縫的大小控制影響物質的分析,大的狹縫寬度代表較強的光源,可提高S/N比,提高分析的靈敏度,但同時伴隨光譜細節的損失,較常用於定量分析;小的狹縫寬度能提高解析度、選擇性,避免其它譜線的干擾,可更清楚的獲得光譜細節,但光源能量較弱,常用於定性分析。
四、(一) 請描述毛細管電泳法(capillary zone electrophoresis)的分離原理。(二) 有三個胺基酸,分別是:甘胺酸(Glycine)、組胺酸(Histidine)及賴胺酸(Lysine),胺基酸的等電點(isoelectric point, pI)分別為Glycine pI=6.0、Histidine pI=7.6及Lysine pI=9.6。請說明何種條件下,以毛細管電泳法可將這三個胺基酸分離。
解:
(一)毛細管電泳法(capillary electrophoresis, CE)
毛細管電泳主要是利用外加高電壓下,分析物在緩衝溶液中解離成不同帶電性質的型式,藉由不同帶電性質在電場中受吸引或排斥的力量產生遷移速率的差異,而造成分離的現象。
毛細管中分析物的移動是由兩種不同的作用力造成:(1)分析物本身的電泳移動速率;(2)緩衝溶液中毛細管壁受外加電壓影響,而產生一種電滲透流(Electroosmotic flow, EOF)。分析物的淨移動速率,即為這兩種力加成的結果。
(二)毛細管等電聚焦電泳法(Capillary Isoelectric Focusing, CIEF)
毛細管等電聚焦電泳法是一種依據兩性物質的樣品,如胺基酸、胺基酸和其他兩性物質的等電點(isoelectric point, pI)而達到電泳分離的技術,如下圖。
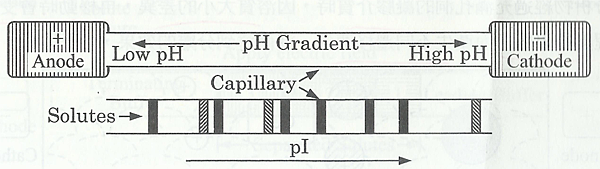
在CIEF中,首先以兩性電解質在毛細管中建立pH 梯度。當陰極置於鹼性溶液中,陽極置於酸性溶液中,施加一電場,帶電的兩性離子和蛋白質在介質中開始遷移,一直到達不帶電區域而聚集,此時pI 值等於pH 值,這個過程稱為“聚焦”,一但聚焦完成,電荷不再移動,可藉由施加電壓或在電極槽內添加鹽類,來推動溶質和兩性緩衝液通過檢測區,在CIEF 中必需要消除EOF,因為EOF 的遷移速度太快,導致兩性電解質在溶質聚焦完成前就流出毛細管。一般可以使用動力學塗壁或共價鍵鍵結的方法,使毛細管內壁改良以降低EOF。
參考資料:
1.http://www.chromedia.org/chromedia?waxtrapp=yarwnEsHiemBpdmBlIEcCIbB
2.http://www.chm.bris.ac.uk/ms/ci-ionisation.xhtml
3.http://140.123.79.88/~ppmpk/MS.pdf
4.楊末雄等;“環境分析−原理與應用”
5.何雍;“最新儀器分析總整理”七版
6.石宇嘉,石宇華;“儀器分析化學”四版
7.https://smallcollation.blogspot.tw/2013/04/capillary-electrophoresis-ce.html#gsc.tab=0
8.Hitachi Z-5000 手冊
9.http://juang.bst.ntu.edu.tw/ECX/Ana3.htm


 留言列表
留言列表