一、試述以碘定量法檢測水中溶氧的方法概要與涉及之化學反應原理。
解:
1.參考「水中溶氧檢測方法-碘定量法(NIEA W422.52B)」 方法概要:
水樣採集盛裝於BOD瓶中,先後加入硫酸亞錳及鹼性碘化物-疊氮化鈉溶液,立即於現場測定,或加入濃硫酸與疊氮化鈉溶液以水封方式保存,測定時再加入硫酸亞錳及鹼性碘化物溶液。亞錳離子於鹼性下生成氫氧化亞錳。水中溶氧會將氫氧化亞錳的沉澱物氧化成高價錳氧化物,當水樣酸化後,高價錳氧化物氧化碘離子生成與溶氧相同當量之碘分子,再以硫代硫酸鈉溶液滴定,由其消耗量即可求得水樣中之溶氧量。
2. Winkler溶氧(Dissolved oxygen, DO)定量法:
分為以下步驟
(1)
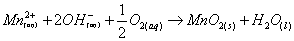
以Mn2+ & OH-固定DO形成棕色的二氧化錳MnO2沉澱物;若水中缺少溶氧時則形成白色的氫氧化錳Mn(OH)2沉澱。
(2) Iodometry:
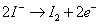
A.

亦即進行溶氧的固定,

B.
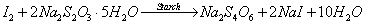
以澱粉作為指示劑,有碘分子存在則呈藍色,當所有的碘分子被還原則呈無色,藉此判斷水樣中溶氧濃度。
二、原子吸收光譜儀為檢測水中重金屬常用之儀器,試說明此儀器之基本構造及運作原理(圖示說明亦可)。
解:

原子吸收光譜法(atomic absorption spectroscopy, AAS),又稱原子吸收分光光度法,是一種根據特定物質基態原子蒸氣對特徵輻射的吸收來對元素進行定量分析的方法。原子吸收光譜儀主要由線光源(如:中空陰極燈)、原子化器(與試液相連)、分光系統(monochromator)、檢測系統。在測定特定元素含量時,用該元素的線光源發射出特徵輻射,經消化分解之試樣溶液在原子化器中發生霧化並解離為氣態基態原子,它吸收通過該區的元素特徵輻射使後者得到減弱,經過分光系統和檢測系統後測得吸光度,最後根據吸光度與被測定元素濃度之間的線性關係,進行該元素的定量分析。
三、分光光度計法是水質分析上經常使用的方法,試說明此方法之基本原理。又使用分光光度計法時,可能的誤差來源為何?
解:
將含有各種波長的混合光分散為各種單色光(monochromatic light),使每種單色光依次通過某一濃度溶液,測定溶液對每種光波的吸光度,繪出吸收光譜。由於物質的吸收光區域和強度與結構密切相關,根據特有的吸收光譜可作分子結構分析。此外,利用特定波長的單色光分別透過標準溶液與待測溶液,比較其吸光度,可作定量分析。簡而言之,利用分光系統以獲得單色光測定物質對光吸收的能力稱之為分光光度計法。
一般分光光度計法中,使用比爾定律(Beer’s law)來決定欲分析物種濃度,比爾定律表示如右:A = εbC
式中A代表分析物種的吸收度,ε代表莫耳吸收係數,b代表使用的容槽光徑長度,C代表分析物種的濃度。
而比爾定律在應用上常有下列的限制:
1. 比爾定律的本身限制:
比爾定律僅能應用在描述稀薄溶液的吸收性質,若分析物濃度在高濃度時(>0.01M),造成吸收物種間的平均距離減少而導致於各粒子互相影響其相鄰者的電荷分布情形。上述狀況亦可能發生在大分子的有機物或樣品處在高濃度的電解質中,造成比爾定律的偏差。值得注意的是高濃度的樣品溶液亦可能發生折射率(n)的改變而造成莫耳吸收係數之變化,即發生偏差之行為,一般而言,可用下式修正:

2. 化學反應造成的偏差:
由於分析物與溶劑發生結合、解離或反應之結果,造成偏差。
3. 多色光的光學偏差:
只有所用的光源為單色光時,待測物才會嚴格的遵守比爾定律,而因連續光源經分光系統的輸出唯一包含所要波長的對稱譜帶,假設分光系統的輸出唯一包含兩波長(l1與l2)的光束,並各自遵守比爾定律,亦即
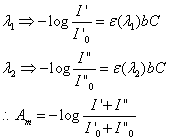
Am為量測到的吸收度,若兩波長的莫耳吸收係數不相等,則偏離線性嚴重。
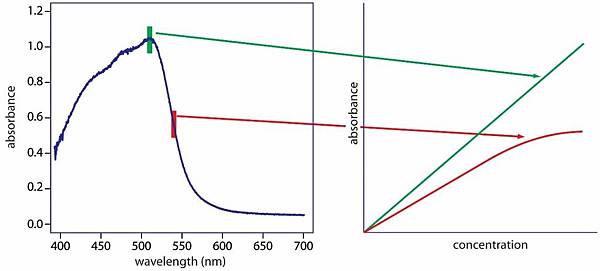
4. 迷射光或散射光造成的偏差:
因儀器內部之鏡面反射達到單光器的出口狹縫造成,一般而言散漫輻射的波長常與所使用的波長相差甚大,惟偵測器對其有所反應造成的偏差,常發生於高濃度與長光徑的系統。
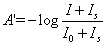
式中A’為測得的吸收度,Is為迷射光強度,I0為入射光強度,I為出射光強度。

四、以電極法測定水樣之氫離子濃度指數時,可能的誤差來源為何?
解:
參考「水之氫離子濃度指數(pH 值)測定方法-電極法(NIEA W424.52A)」三、干擾
1. 樣品之 pH 值太高或太低均容易造成測定值的誤差,當樣品的 pH 值大於 10 時,測定值容易偏低,可用低鈉誤差(Low-sodium error)電極來降低誤差。樣品之 pH 值小於 1時,則測定值容易偏高。
2. 溫度對 pH 測定之影響:pH 計之電極電位輸出隨溫度而改變,可由溫度補償裝置校正;水解離常數及電解質之離子平衡隨溫度而異,樣品 pH 值因而改變,故測定時應同時記錄水溫。
3. 當電極被雜質披覆時,將造成測定誤差。如電極被油脂類物質披覆而不易沖洗掉,可以使用
(1) 超音波洗淨機洗淨。
(2) 用清潔劑洗淨後再用清水沖洗數次,使電極底部三分之一部份浸泡於 1:10 鹽酸溶液中,最後再用水完全潤溼。
(3) 依製造廠商之說明清洗。
一般而言,pH電極的誤差來自:
1. Standards: A pH measurement cannot be more accurate than our standards, which are typically ±0.01 pH unit.
2. Junction potential: A junction potential exists at the porous plug near the bottom of the electrode in the following figure . If the ionic composition of the analyte solution is different from that of the standard buffer, the junction potential will change even if the pH of the two solutions is the same . This effect gives an uncertainty of at least ~0.01 pH unit.
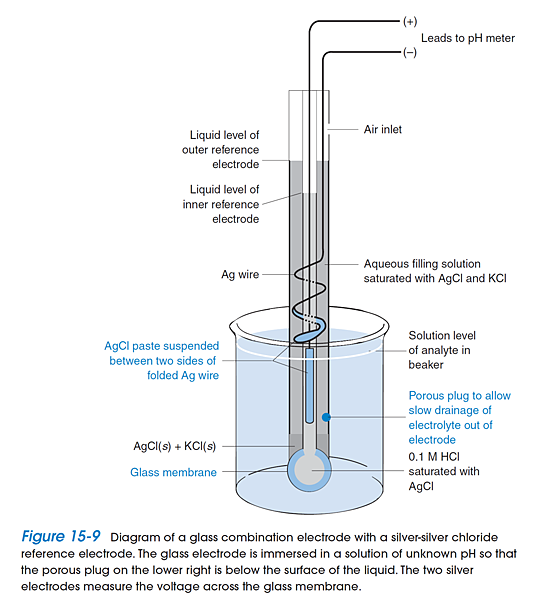
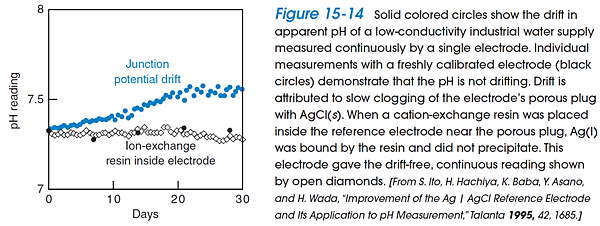
3. Junction potential drift: Most combination electrodes have a Ag ƒ AgCl reference electrode containing saturated KCl solution. More than 350 mg Ag/L dissolve in the KCl, mainly as AgCl43- and AgCl32- In the porous plug, KCl is diluted and AgCl can precipitate. If analyte solution contains a reducing agent, Ag(s) also can precipitate in the plug. Both effects change the junction potential, causing a slow drift of the pH reading (solid colored circles in the following figure). This error can be compensated for this error by recalibrating the electrode every 2 h.
4. Sodium error: When [H+] is very low and [Na+] is high, the electrode responds to and the apparent pH is lower than the true pH. This is called the sodium error or alkaline error.
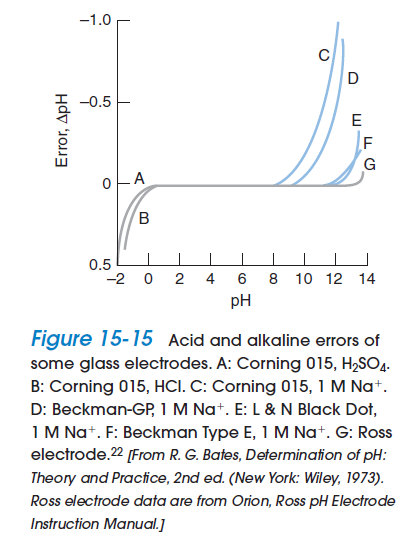
5. Acid error: In strong acid, the measured pH is higher than the actual pH, perhaps because the glass is saturated with [H+] and cannot be further protonated.
6. Equilibration time: It takes time for an electrode to equilibrate with a solution. A well buffered solution requires ~30 s with adequate stirring. A poorly buffered solution (such as one near the equivalence point of a titration) needs many minutes.
7. Hydration of glass: A dry electrode requires several hours of soaking before it responds to H+ correctly.
8. Temperature: A pH meter should be calibrated at the same temperature at which the measurement will be made.
9. Cleaning: If an electrode has been exposed to a hydrophobic liquid, such as oil, it should be cleaned with a solvent that will dissolve the liquid and then conditioned well in aqueous solution. The reading of an improperly cleaned electrode can drift for hours while the electrode re-equilibrates with aqueous solution.
五、水樣常因物理、化學或生物的作用而使水質發生變化,因此須採取某些措施來保存樣品(sample stabilization)。試述保存樣品之基本作法。
解:
|
目的 |
保存方法 |
相關水質測項 |
|
抑制微生物生長及揮發性物質逸散 |
4oC冷卻 |
生化需氧量(BOD)、臭味(Odor)、酸度、鹼度、有機碳、有機磷 |
|
金屬離子,維持pH < 2 |
添加硝酸(HNO3) |
金屬離子(重金屬) |
|
抑制微生物生長 |
添加硫酸(H2SO4) |
有機碳、化學需氧量(COD)、油脂 |
|
形成銨鹽(NH4+),避免氨(NH3)或胺(R-NH2)的逸散 |
添加硫酸(H2SO4) |
氨氮、有機胺 |
|
形成鈉鹽 |
添加氫氧化鈉(NaOH) |
揮發性酸、硫化物(S2-)、氰化物(CN-) |
|
殺菌 |
添加氯化汞(HgCl2) |
氮化物、磷化物 |
|
固定特殊成分 |
添加特殊試劑 |
溶氧(DO) |
六、何謂方法偵測極限(MDL)?試說明如何決定 MDL?
解:
請參閱http://albert1225.pixnet.net/blog/post/42761027
參考資料:
- 江漢全,水質分析,第2版
- 水中溶氧檢測方法-碘定量法 (NIEA W422.52B)
- https://zh.wikipedia.org/wiki/%E5%8E%9F%E5%AD%90%E5%90%B8%E6%94%B6%E5%85%89%E8%B0%B1%E6%B3%95
- http://www.hsc.csu.edu.au/chemistry/core/monitoring/chem943/943net.html
- https://zh.wikipedia.org/wiki/%E5%88%86%E5%85%89%E5%85%89%E5%BA%A6%E6%B3%95
- 黃秀蓮、張大年、何燧源,環境分析與監測
- http://pharmaxchange.info/press/2012/05/ultraviolet-visible-uv-vis-spectroscopy-%E2%80%93-limitations-and-deviations-of-beer-lambert-law/
- 石宇嘉、石宇華,儀器分析化學,第2版
- http://chemwiki.ucdavis.edu/Analytical_Chemistry/Analytical_Chemistry_2.0/10_Spectroscopic_Methods/10B%3A_Spectroscopy_Based_on_Absorption
- http://pephoton.blogspot.tw/
- Harris, D. C.; Quantitative Chemical Analysis, 7th. Ed.
- 石宇華、史文龍,分析化學之系統剖析,第6版
- http://www.niea.gov.tw/analysis/information/pdf/PA107%E7%92%B0%E5%A2%83%E6%AA%A2%E9%A9%97%E6%96%B9%E6%B3%95%E5%81%B5%E6%B8%AC%E6%A5%B5%E9%99%90%E6%B8%AC%E5%AE%9A%E6%8C%87%E5%BC%95931004.pdf
- http://www.niea.gov.tw/analysis/information/pdf/PA107%E7%92%B0%E5%A2%83%E6%AA%A2%E9%A9%97%E6%96%B9%E6%B3%95%E5%81%B5%E6%B8%AC%E6%A5%B5%E9%99%90%E6%B8%AC%E5%AE%9A%E6%8C%87%E5%BC%95931004.pdf


 留言列表
留言列表