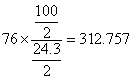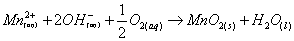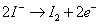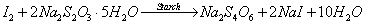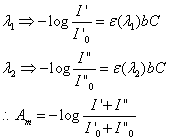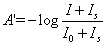一、移液管(Pipette)上標示“5 in 1/10 ml, TD 20°C”,請說明其意義。
解:
Specifications on a pipette as shown above indicate that the pipette is calibrated in 1/10ml divisions and will deliver up to 5.0 ml within published tolerance levels at 20oC.
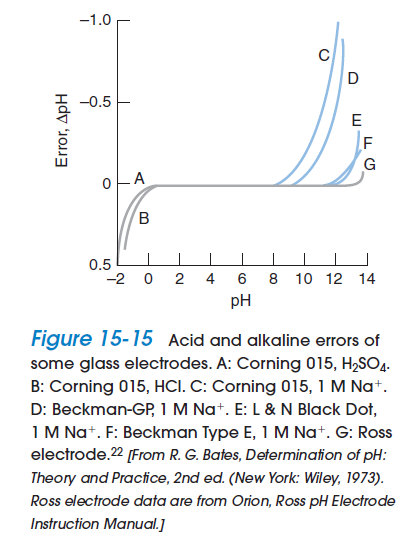
二、請解釋為何酸度不存在於pH 大於8.5 的水樣中?另說明pH 與酸度之主要不同點為何?
解:
(一)對於水體而言,酸度係指水溶液中和鹼的能力(中和至當量點的能力),大多數的自然水體、家庭廢水及部分工業廢水,主要均是二氧化碳─碳酸系統所緩衝,當pH>8.5(pH = 8.3為甲基橙指示劑的滴定終點),水中的物種大部分為CO32-與OH-不具有中和鹼的能力,故酸度不存在。
(二)氫離子濃度指數(pH)定義為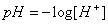 ,係為表示水中氫離子濃度的一種方式,常用來表示水溶液在特定溫度下的酸鹼性,與酸度代表水溶液中和鹼的能力不同。
,係為表示水中氫離子濃度的一種方式,常用來表示水溶液在特定溫度下的酸鹼性,與酸度代表水溶液中和鹼的能力不同。
三、大腸桿菌群MF 法測試所使用之水樣體積是以何因素決定?此法較適合用於自來水或廢污水?原因為何?
解:
濾膜法的基本原理為大腸桿菌群在含乳醣的Endotype培養基中,於35℃、24小時內產生具金屬光澤菌落;所有缺乏金屬光澤的菌落,均判定為非大腸桿菌群。
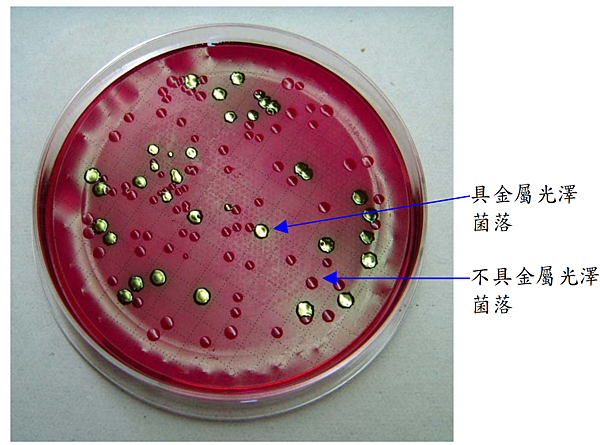
大腸桿菌群濾膜法培養結果
所使用的水樣體積如下:
| 方法 | 適用範圍 | 水樣體積 |
|
水中大腸桿菌 群檢測方法- 濾膜法(NIEA E202.55B) |
地面水體、地下水體、廢水、污水、放流水及海域地面水體之大腸桿菌群檢測。 | 10mL,並視水樣中微生物可能濃度範圍進行水樣稀釋步驟。 |
| 飲用水中大腸桿菌群檢測方法-濾膜法(NIEA E230.55B) | 飲用水及飲用水水源之大腸桿菌群檢測。 | 100mL |
故濾膜法較適用於純淨的水樣,如飲用水水樣,並可使用大量體積的水樣進行分析,增加方法靈敏度。
四、下列那些儀器(僅以英文簡寫方式表示)與有機分析無關?
(一)LC
(二)ICP
(三)FID
(四)IC
(五)GC
(六)UV/Vis
解:
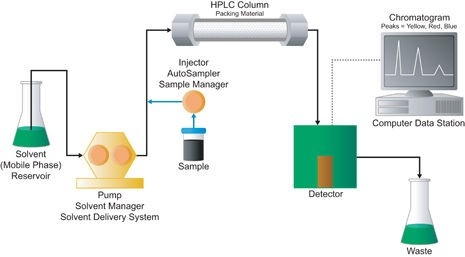
(一)液相層析儀(LC):
液相層析儀適用於半揮發性和非揮發性有機化合物或遇熱易被裂解的有機待測物,應用此方法進行分析的先決條件是待測物必須溶於作為動相的溶劑中,因待測物與動相、靜相作用力不同而達成分離。在正相(Normal phase)高效能液相層析儀系統中,移動相的極性較低,靜相的極性較高;在逆相(Reverse phase)高效能液相層析儀系統中,移動相的極性較高,靜相的極性較低。逆相高效能液相層析儀,係環境和廢棄物樣品中非揮發性標的有機待測物的選用檢測方法。
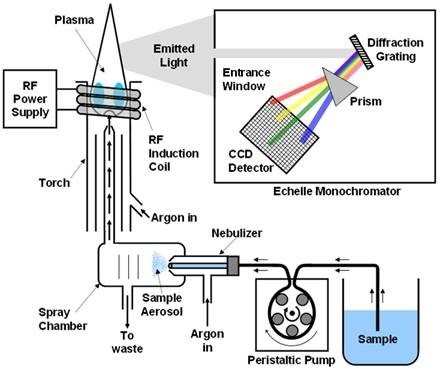
(二)感應耦合電漿發射光譜儀(ICP):
樣品用氬氣帶入先經噴霧器霧化後,利用高頻電磁感應產生的高溫氬氣電漿,使導入電漿中的樣品受熱而起一系列的去溶劑、分解、原子化/離子化及激發等反應,當原子由激發態返回低能階狀態時各元素發射出其特定的多條光譜線,經分光儀分光,再經由光電倍增管偵測其光譜線強度,根據這些訊號的波長及強度資料,可進行元素的定性及定量分析。
(三)火焰游離偵測器(FID):
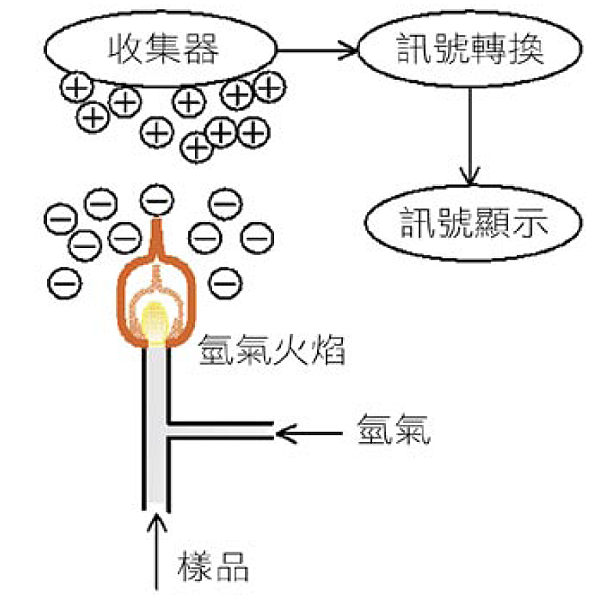
火焰游離偵測器主要是利用火焰燃燒的方式以游離有機物質,由於游離後的物質形成導電之離子,可使得接收器中的電流訊號增強,而且電流訊號與有機物之碳數成正比關係,因此該偵測器非常適合用於具CH-基之有機物。
(四)離子層析儀(IC):
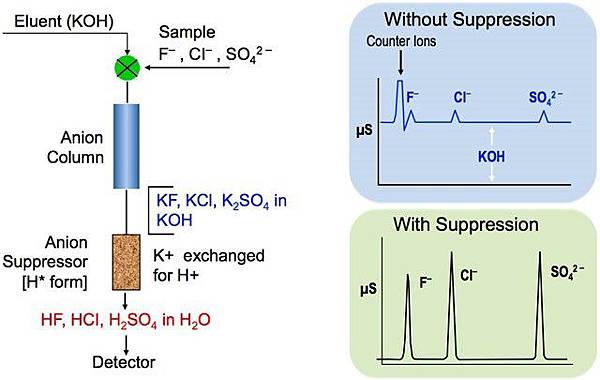
水樣中之待測陰(陽)離子,隨特定流洗液流經一系列之離子交換層析管柱時,即因其與低容量之強鹼性交換樹脂間親和力之不同而被分離。分離後之待測陰(陽)離子再流經一高容量之陽(陰)離子交換樹脂之抑制裝置,而被轉換成具高導電度酸之形態,流洗液則轉換成低導電度之碳酸。經轉換後之待測陰(陽)離子再流經適當之偵測器,即可依其滯留時間及波峰面積予以定性及定量。
(五)氣相層析儀(GC):
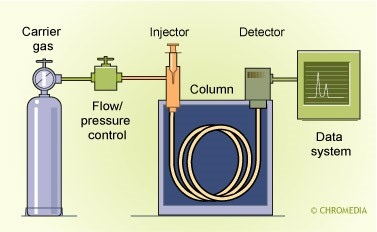
藉惰性氣體(移動相)通過靜相(矽膠油或類似的物質)達到分離的效果,混合物中的各成份在靜相和移動相之間的分配係數不相同(即親和力不同),使其在管柱中的滯留時間不相同而得以分離出來。若化合物與靜相親和力較強,則沖提較慢(即滯留時間長),而化合物與移動相的親和力較強,則沖提較快(即滯留時間短)。適用於在分析條件下不易被裂解或發生化學結構改變的可揮發性有機物。
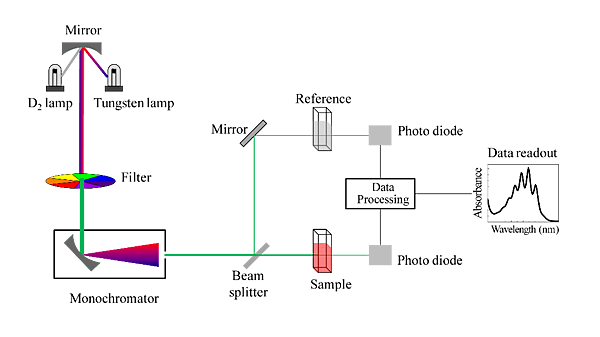
(六)紫外光/可見光分光光度計(UV/Vis):
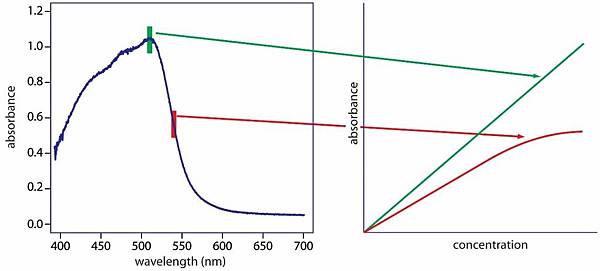
一般而言,所有的溶液均會顯示主要餘光的顏色或補色,比色法即是利用有色溶液的光吸收度與濃度的關係,進行量化分析的物化方法。而分光光度計則利用可見光源或紫外光源,透過菱鏡或光柵的效應,產生特定波長範圍的光,並讓該特定波長的光經過樣品後,藉由光偵測器(Photocell)量測樣品對光源的吸收度或穿透度,再以吸收度或穿透度的差異對樣品進行定量。
五、下列五種用途所需使用的實驗室品管樣品(Laboratory QC Sample)為何?
(一)決定基質干擾對水樣分析準確度的影響程度
(二)決定批次水樣分析的精確度
(三)確定實驗室污染不會對數據結果造成誤判
(四)了解儀器分析時前批次分析之記憶效應(Memory Effect or Carryover)是否存在?
解:
(一)添加樣品(Spiked sample)
又稱基質添加樣品(Matrix spike sample)。指在檢驗室將一樣品取二等份,其中一份添加適當量之待測物標準品,即為添加樣品,但水中揮發性有機物之添加樣品應為現場重複採樣之樣品添加標準品者。添加樣品分析之結果可了解樣品中有無基質干擾或所用的檢測方法是否適當。
(二)重複樣品(Duplicate sample)
在檢驗室將一樣品取二等份,依相同前處理及分析步驟檢測者,但水中揮發性有機物應為現場重複採樣之樣品。由重複樣品之分析可確定分析結果之精密度。
(三)方法空白樣品(Method blank sample)
又稱實驗室空白樣品(Laboratory blank sample)或試劑空白樣品(Reagent blank sample)。指為監測整個分析過程中可能導入污染而設計之樣品,例如:以不含待測物之氣體、試劑水、吸收液、吸附介質、濾材、乾淨陶土或海砂,由方法空白樣品之分析結果,可判知樣品在分析過程是否遭受污染或樣品之背景值。
(四)記憶干擾或跨次干擾(Carry-over)問題常發生於連續分析濃度差異甚大之樣品或標準品時,樣品中待測物沉積並滯留,藉由延長樣品間洗滌時間來避免此類干擾效應之發生,可使用實驗室試劑空白來檢查是否有交叉污染。
六、在以滴定法量測溶氧(DO)及生化需氧量(BOD)時,其計算式中均出現8000之轉換值(conversion factor),說明其由來。另在DO滴定時,如消耗0.025 N之硫代硫酸鈉溶液8.0 ml於200ml 水樣中,請計算此水樣之DO 值。
解:
(一)考慮1分子的氧氣反應後生成氧二價陰離子,共計轉移4個電子,考慮當量及一般以mg/L表示溶氧, 當量=分子量/電子轉移數,故
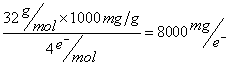
(二)依「水中溶氧檢測方法-碘定量法(NIEA W422.53B)」
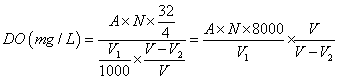
A =水樣消耗之硫代硫酸鈉滴定溶液體積(mL)
N=硫代硫酸鈉滴定溶液當量濃度(N)=莫耳濃度(M)
V1 = 滴定用的水樣體積(mL)
V =BOD 瓶之體積(mL),一般為300 mL
V2 = 2 mL(立即測定)或6.7 mL(無法立即測定)
故以V2 = 2 mL估算,溶氧為8.1 mg/L
七、COD 測試所使用之藥劑為何?其各別功能為何?另若有大顆粒存在時,需作何種前處理?
解:
化學需氧量(Chemical Oxygen Demand, COD)是以化學方法測量水樣中有機物被強氧化劑氧化時所消耗之氧的相當量,用以表示水中有機物量的多寡。水樣在一定條件下,以氧化1升水樣中還原性物質所消耗的氧化劑的量為指標,推算每升水樣全部被氧化後,需要的氧的毫克數,以mg/L表示。它反映了水中受還原性物質污染的程度。該指標也作為有機物相對含量的綜合指標之一。
(一)使用之藥劑如下
1.水樣的氧化劑為高錳酸鉀或重鉻酸鉀。
2.硫酸汞為用來排除氯離子干擾,硫酸汞與氯離子重量比為10:1。
3.硫酸銀具有催化作用,用來加速揮發性直鏈脂肪族化合物的分解。
4.硫酸用來提供酸性的有機物氧化條件。
5.胺基磺酸(Sulfamic acid)係用來排除亞硝酸鹽類的干擾,每1 mg的亞硝酸鹽氮須10 mg胺基磺酸去除,惟須在空白樣品中添加等量的胺基磺酸進行分析。
6.硫酸亞鐵胺溶液為用來標定重鉻酸鉀溶液之試劑,並配合菲羅?作為指試劑。
7.鄰苯二甲酸氫鉀作為COD標準溶液(作為查核品)。
(二)待分析水樣中若有懸浮物質存在時,可先以攪拌機或均質機打碎攪勻。
參考資料:
1.江漢全,“水質分析”,第2版。
2.石濤,“環境化學”,第6版。
3.石濤,“環境微生物”,第7版。
4.“大腸桿菌群與大腸桿菌的差異?”https://iqc.tw/114
5.水中大腸桿菌群檢測方法-濾膜法(NIEA E202.55B)
6.飲用水中大腸桿菌群檢測方法-濾膜法(NIEA E230.55B)
7.水質檢測方法總則(NIEA W102.51C)
8.水中溶氧檢測方法-碘定量法(NIEA W422.53B)
9.https://zh.wikipedia.org/wiki/%E5%8C%96%E5%AD%A6%E9%9C%80%E6%B0%A7%E9%87%8F
10.水中化學需氧量檢測方法-重鉻酸鉀迴流法(NIEA W515.55A)
11.水中化學需氧量檢測方法-密閉式重鉻酸鉀迴流法 (NIEA W517.53B)