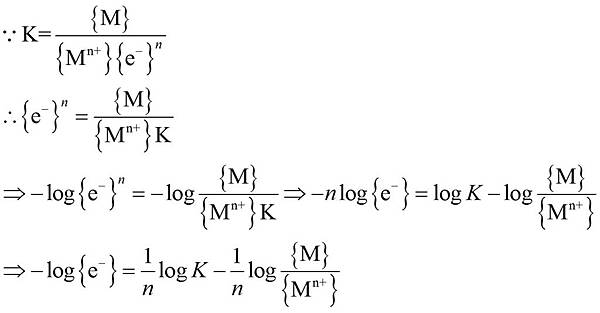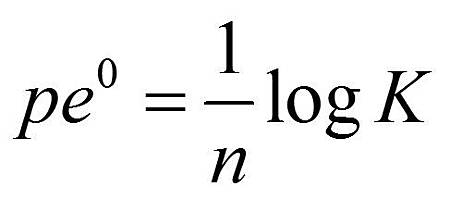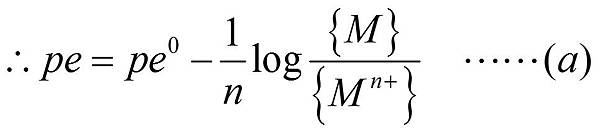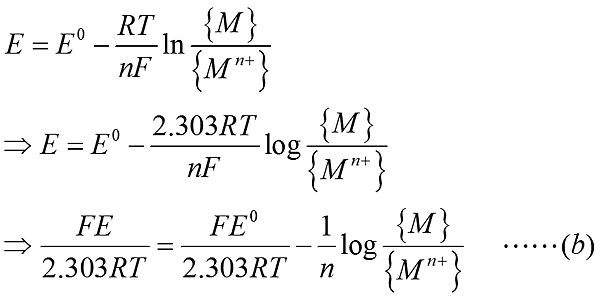一、前言
如同氫離子濃度指數pH值用來詮釋酸鹼的概念,環境工程上在對氧化還原反應與水系統的探討,參採類似的概念配合圖解的方式來探討水系統裡的氧化還原概念。
二、定義與導式
如同氫離子活性(activity)與pH的概念,先定義電子活性度為
pe = -log {e-}
假設一個還原半反應為
Mn+ + ne- → M K:平衡常數 E0:半反應的標準還原電位 {A}:表物種活性,A為M、Mn+或e-
而可將
另外考慮此半反應的能斯特方程式(Nernst equation)
由上面的(a)與(b)所以我們可以得到以下的關係
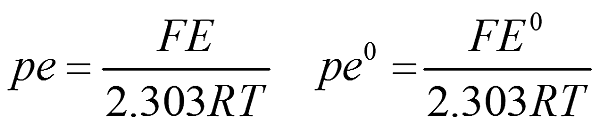
考慮吉布斯自由能(Gibbs free energy)變化量表示 DG = -nFE DG0 = -nFE0

上述式子中,F:法拉定常數,96500 C/mole;R:理想氣體常數,8.314 J/mole;T為絕對溫度(K);E為還原電位(V)
三、討論
- pe與自由能變化有關。
- pe僅適用半反應,為無法明確表示半反應的平衡位置。
- 若同一溶液系統,兩個半反應的pe值相等,則表示這些反應平衡。
- 當pe上升,電子活性下降,還原半反應向左進行,系統趨向氧化態。
- pe↓,電子活性上升,還原半反應向右進行,系統趨向還原態。
- 自然界水系統的氧化邊界(自然界中最強能存在的氧化劑為氧氣):O2(g) + 4H+(aq) + 4e- → 2H2O(l) pe0 = 20.8
- 自然界水系統的還原邊界(自然界中最強能存在的還原劑為氫氣):2H2O(l) + 2e- → H2(g) + 2OH-(aq) pe0 = -14
四、經典試題解析
- 環保局有一天派你至一口老井檢測地下水水質,為求具代表性,你將電極棒直接放入井內測試,結果pH值僅6.0,不符合飲用水標準(6.5)。但當你將水樣帶回實驗室時,以桌上型pH計所測之pH值為7.0,請問原因何在?(假設兩臺pH計均為準確)。又酸雨定義為pH小於何值,訂此值之原因為何?[95普考 環境化學概要]
解答:
(1) 考慮水系統的氧化邊界(自然界中最強能存在的氧化劑為氧氣):O2(g) + 4H+(aq) + 4e- → 2H2O(l) pe0 = 20.8 ,故因氧
氣的消耗而導致pH的上升。
(2) 過去酸雨定義為雨水pH < 5.6係因當大氣中二氧化碳的含量為330ppm(v/v)時,此時純水的氫離子濃度指數為5.6,然
而由於自然界中所產生的其他酸性物質如甲酸或其他有機酸等的影響,使大氣未受人為污染的雨水之氫離子濃度指數
即接近5.0,因此自1990年起許多國家均以pH < 5.0作為酸雨的定義。
- 放流水出口pH = 7.8,25oC下,經一無經驗之生手取回實驗室,置於陽光充分照射的地方,水樣發生變化,發現pH = 10,實驗室目前大氣含氧量40%,假設反應O2(g) + 4H+(aq) + 4e- → 2H2O(l) pe0 = 20.8,支配整個水樣的狀況則試問兩個位置pe值之變化與氧化還原電位的變化?
解答:
(1)
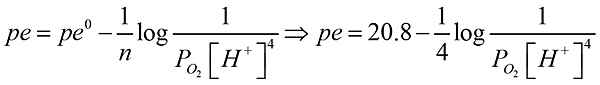
放流口:O2分壓為0.21atm,[H+] = 10-7.8 故pe = 12.83
實驗室:O2分壓為0.4atm,[H+] = 10-10 故pe = 10.5
pe減少2.33
(2) 又
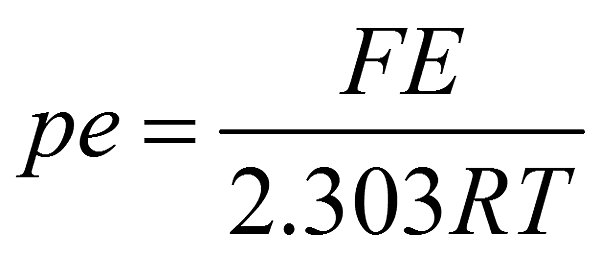
故DE變化為0.14V
- 以下列條件計算一湖泊底部厭氧水體中二氧化碳與甲烷之壓力比值。已知該水體pH = 4,溶氧分壓為0.10 atm,相關的反應式如下:
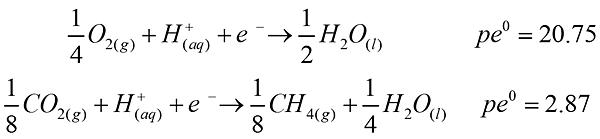 [102高考3等 環境化學與環境微生物]
[102高考3等 環境化學與環境微生物]
解答:平衡時兩個半反應的pe相等
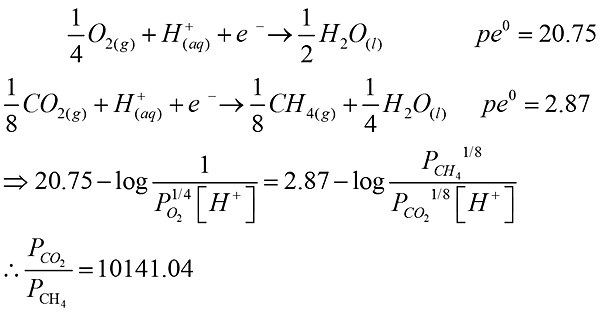
五、參考資料與延伸閱讀
- 石濤;"環境化學" 6版
- 石濤;"環境化學與環境微生物分類題庫" 3版
- 石宇華,史文龍;"分析化學之系統剖析" 6版
- 施英隆;"環境化學" 6版